Isotherme d'adsorption et de désorption de l'eau
L'
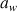 dans un produit alimentaire dépend principalement de sa teneur en eau (X) et de sa température
dans un produit alimentaire dépend principalement de sa teneur en eau (X) et de sa température
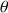 . La courbe représentant, pour une température
. La courbe représentant, pour une température
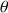 donnée, la X d'un produit en fonction de la valeur de l'
donnée, la X d'un produit en fonction de la valeur de l'
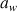 ou de l'HRE est appelée :
ou de l'HRE est appelée :
Isotherme d'adsorption, si elle a été déterminée expérimentalement en partant d'un produit sec.
Isotherme de désorption, si elle a été déterminée expérimentalement en partant d'un produit saturé en eau.
On peut représenter graphiquement la courbe appelée isotherme d'adsorption-désorption, obtenue en portant :
En abscisse : soit l'
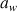 , soit l'HRE
, soit l'HRE
En ordonnée : la teneur en eau du produit exprimée en g d'eau pour 100 g de matière sèche (% MS)
Les deux courbes sont en général différentes (Figure 1) car le séchage d'un produit (passage d'
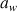 = 1 à
= 1 à
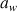 < 0,6) entraîne des modifications de structure et de porosité irréversibles.
< 0,6) entraîne des modifications de structure et de porosité irréversibles.
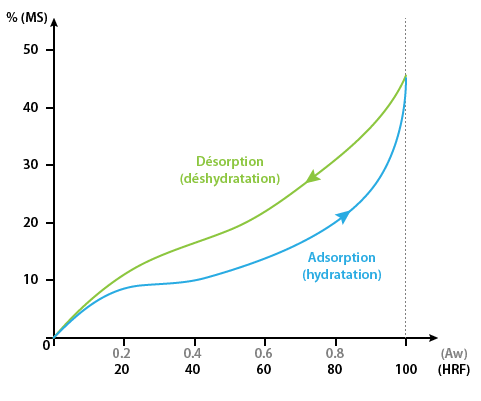
En séchage, on s'intéresse particulièrement à la courbe de désorption qui peut être divisée en 3 zones (Figure 1) :
Zone 1 (0 <
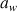 < 0,2) : Constitution d'une monocouche moléculaire à la surface du produit (forces de Van der Waals entre groupements hydrophiles et molécules d'eau). L'adsorption se fait progressivement jusqu'à constituer une monocouche recouvrant la surface externe et les pores du produit. L'eau est dans un état lié (rigidité, fortes liaisons hydrogènes). Le passage à la zone suivante s'effectue quand toute la surface est saturée.
< 0,2) : Constitution d'une monocouche moléculaire à la surface du produit (forces de Van der Waals entre groupements hydrophiles et molécules d'eau). L'adsorption se fait progressivement jusqu'à constituer une monocouche recouvrant la surface externe et les pores du produit. L'eau est dans un état lié (rigidité, fortes liaisons hydrogènes). Le passage à la zone suivante s'effectue quand toute la surface est saturée.Zone 2 (0.2 <
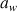 < 0,6) : Adsorption des molécules d'hydrogène sur la monocouche initiale, ou inclusion de molécules d'eau par capillarité. L'isotherme est linéaire dans cette zone. Il s'agit d'un état intermédiaire entre solide et liquide.
< 0,6) : Adsorption des molécules d'hydrogène sur la monocouche initiale, ou inclusion de molécules d'eau par capillarité. L'isotherme est linéaire dans cette zone. Il s'agit d'un état intermédiaire entre solide et liquide.Zone 3 (
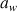 > 0,6) : Eau présente à l'état liquide dans les pores du matériau. L'eau micro-capillaire constitue une phase continue.
> 0,6) : Eau présente à l'état liquide dans les pores du matériau. L'eau micro-capillaire constitue une phase continue.
L'analyse de l'isotherme d'adsorption et de désorption montre que les 2 courbes ne sont pas superposées. Pour une teneur en eau donnée, l'équilibre de la désorption s'établit pour des
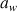 plus faibles que l'équilibre de l'adsorption. C'est le phénomène d'hystérésis, qui ne se manifeste que pour des valeurs d'
plus faibles que l'équilibre de l'adsorption. C'est le phénomène d'hystérésis, qui ne se manifeste que pour des valeurs d'
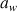 > 0,2. L'hystérésis s'explique par deux observations :
> 0,2. L'hystérésis s'explique par deux observations :
Les pores des aliments sont en général plus petits en surface qu'en profondeur. La pression de vapeur d'eau nécessaire au remplissage est plus élevée que celle à laquelle les pores se vident ;
L'hystérésis est surtout marquée dans les fruits et les légumes car les sucres de ces aliments forment des solutions sursaturées qui ne précipitent pas lors de la déshydratation.
Intérêt des isothermes d'adsorption en technologie alimentaire
Du point de vue thermodynamique, les isothermes d'adsorption fournissent des informations sur les enthalpies de "sorption" et sur le type de liaison de l'eau avec la matière sèche du produit ;
Du point de vue structurel, elles permettent de mieux comprendre le rôle de la taille des particules, de l'état amorphe, et de la surface spécifique dans les phénomènes de désorption ou adsorption de la vapeur d'eau ;
Du point de vue technologique, elles sont utiles à la prédiction de la durée de conservation des aliments, au contrôle du séchage et à la prévention de certains accidents comme le collage ou la prise en masse des produits alimentaires pulvérulents. C'est la composition relative en protéines, amidons, sels minéraux et saccharose qui détermine les isothermes d'adsorption. L'objectif étant d'atteindre des
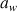 faibles ; pour cela, on peut faire appel à divers additifs comme le sel, le saccharose pour abaisser l'
faibles ; pour cela, on peut faire appel à divers additifs comme le sel, le saccharose pour abaisser l'
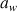 sans changer la teneur en eau. Ces additifs sont précieux pour les aliments à humidité moyenne < 35 % et 0,6 <
sans changer la teneur en eau. Ces additifs sont précieux pour les aliments à humidité moyenne < 35 % et 0,6 <
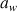 < 0,8. Ils sont stables plusieurs semaines en emballage étanche (saucissons secs, fruits secs, biscuits,...).
< 0,8. Ils sont stables plusieurs semaines en emballage étanche (saucissons secs, fruits secs, biscuits,...). Par ailleurs, l'état d'un composé influence sur le taux de fixation de l'eau ; par exemple, à humidité donnée, le saccharose amorphe retient plus d'eau que le saccharose cristallisé car la transition d'un état à l'autre provoque une expulsion d'eau à mesure que le cristal s'ordonne. Cette transformation est liée à la fois à l'humidité et à la température. Lors de la cristallisation, l'eau libérée dissout les cristaux des couches externes, alors que les couches internes consolident leur cristallisation et se prennent en masse. L'eau expulsée du cristal peut aussi se re-localiser sur d'autres constituants et donne une masse collante. On peut citer les exemples suivants :
Le café soluble déshydraté prend en masse en vieillissant (surtout lorsque l'emballage n'est plus étanche) ;
Le lait en poudre subit la même transformation ;
Les bonbons deviennent collants à l'extérieur (les cristaux passent à l'état amorphe) et durs à l'intérieur par cristallisation et expulsion d'eau vers l'extérieur.
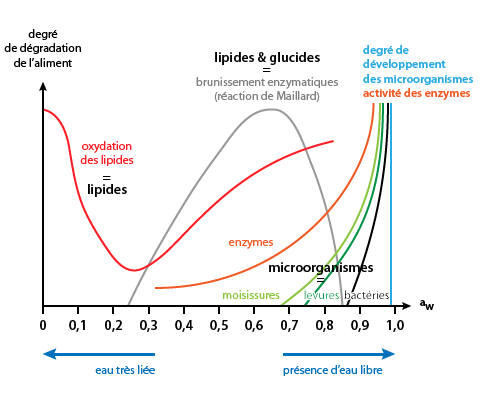
Plus l'
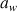 dans un aliment est faible, mieux il se conserve, car la prolifération microbienne et les réactions chimiques sont limitées (Figure 2). Les courbes des isothermes sont utiles pour prévoir le comportement des aliments suite aux traitements technologiques et aux conditions de stockage.
dans un aliment est faible, mieux il se conserve, car la prolifération microbienne et les réactions chimiques sont limitées (Figure 2). Les courbes des isothermes sont utiles pour prévoir le comportement des aliments suite aux traitements technologiques et aux conditions de stockage.